缺血再灌注损伤是缺血组织血液再灌注时引起比缺血更严重的损伤,在临床上是常见的症状,其致病机理复杂,而缺血-再灌注的过程往往也伴随着缺氧-富氧的过程,线粒体呼吸链在这过程中会突发产生大量的超氧自由基(O2•-),这也是导致组织损伤的主要诱因之一。经过亿万年进化,细胞内已形成大量的氧化还原酶来维持胞内氧化还原稳态,其中主要负责清除O2•-的是超氧化物歧化酶(SOD),在哺乳动物细胞内,SOD酶主要包括三种亚型,线粒体Mn-SOD,胞质Cu/Zn-SOD和胞外Cu/Zn-SOD。近日,南开大学黄兴禄教授、孔德领教授与庄洁副教授合作,利用纳米酶技术仿生设计和合成了线粒体Mn-SOD,并探索其在缓解心脏缺血再灌注损伤上的应用。相关成果近日已在Advanced Materials上在线发表。
本研究基于合成生物学从头设计(de novo design)的理念,选用人源铁蛋白重链重组蛋白(FTn)作为蛋白骨架,利用其自身天然亲和金属离子的能力,合成了可靶向细胞内线粒体的铁蛋白Mn-SOD纳米酶(Mito-Fenozyme)。结果显示,该纳米酶具有较高的SOD酶活性,并且显示出比较好的过氧化氢酶(CAT)活性,更为有意思的是,该纳米酶没有过氧化物酶(POD)活性。而纳米酶材料基本都会展现出一定的POD活性,这一特性不仅能够通过SOD-CAT级联反应有效清除O2•-,还能避免由POD诱导产生高细胞毒性的羟基自由基(OH•-)。细胞试验也进一步证实了,该纳米酶具有靶向线粒体能力及清除线粒体来源O2•-的优势。
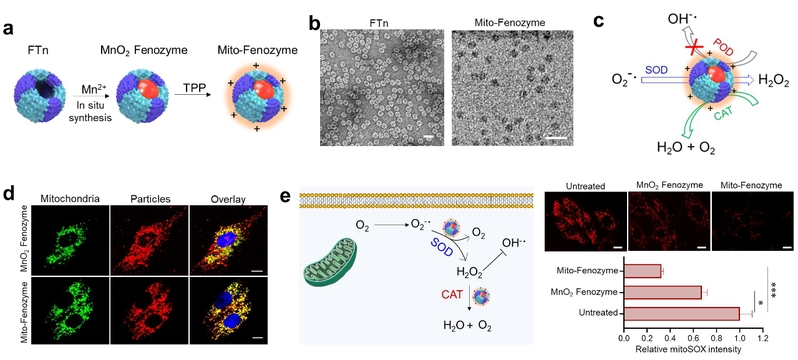
(a)Mito-Fenozyme的设计;(b)FTn与Mito-Fenozyme电镜图;(c)Mito-Fenozyme酶学特性示意图;(d)细胞内线粒体靶向能力;(e)Mito-Fenozyme通过级联反应有效清除胞内线粒体O2•-。
他们在这之前的研究中发现组织缺氧情况下,会高表达铁蛋白的受体(PNAS, 2017; ACS NANO 2019;Biomaterials,2020)。组织缺血也会伴随着缺氧的发生,本研究也发现铁蛋白能够靶向缺血再灌注心脏组织,并且呈现出在缺血区域聚集分布的特点。尾静脉注射小鼠模型后,能有效的缓解心脏组织损伤导致的心脏功能衰减。
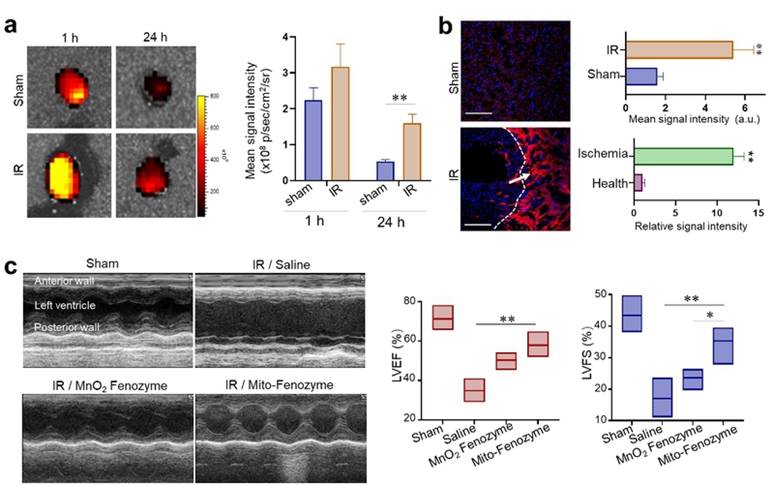
(a)FTn在缺血再灌注心脏的靶向能力;(b)FTn在心脏组织缺血区的分布情况;(c)心脏超声证明Mito-Fenozyme在缓解缺血再灌注心脏组织损伤上的效果。
除了通过全身靶向递送外,本研究也将Mito-Fenozyme与高粘性心脏补片(patch)复合,制备了可直接贴到心脏缺血部位的纳米酶补片(Mitofegel)。研究证实,纳米酶补片通过非侵入方式局部贴到心脏缺血部位,具有长时间的滞留效果,复合的纳米酶材料能够有效的实现在心脏组织的深度渗透,从而对心脏组织起到保护作用。
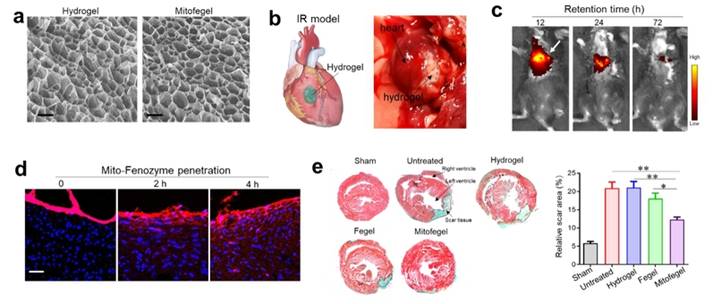
(a)高粘性心脏补片水凝胶扫描电镜图;(b)补片与心脏粘合;补片在心脏的(c)滞留和(d)渗透;(e)马氏染色验证Mitofegel对心脏组织坏死的保护作用。
本研究基于重组铁蛋白作为蛋白骨架,利用其自身的特性,生物仿生设计了可靶向缺血心脏组织及线粒体的纳米酶,并验证了它们在保护缺血再灌注动物模型上的作用。以蛋白作为骨架来从头设计纳米酶能够更好的贴近酶的特性,为未来纳米酶的设计提供了新的选择。
相关文献:
1. Zhang Y, Khalique A, Du X, Gao Z, Wu J, Zhang X, Zhang R, Sun Z, Liu Q, Xu Z, Midgley AC, Wang L, Yan X, Zhuang J, Kong D, Huang X. Biomimetic Design of Mitochondria-Targeted Hybrid Nanozymes as Superoxide Scavengers. Adv Mater. 2021 Jan 22;e2006570.
2. Huang X, Chisholm J, Zhuang J, Xiao Y, Duncan G, Chen X, Suk JS, Hanes J. Protein nanocages that penetrate airway mucus and tumor tissue. Proc Natl Acad Sci U S A. 2017 Aug 8;114(32):E6595-E6602.
3. Huang X, Zhuang J, Chung SW, Huang B, Halpert G, Negron K, Sun X, Yang J, Oh Y, Hwang PM, Hanes J, Suk JS. Hypoxia-tropic Protein Nanocages for Modulation of Tumor- and Chemotherapy-Associated Hypoxia. ACS Nano. 2019 Jan 22;13(1):236-247.
4. Gao F, Wu J, Gao H, Hu X, Liu L, Midgley AC, Liu Q, Sun Z, Liu Y, Ding D, Wang Y, Kong D, Huang X. Hypoxia-tropic nanozymes as oxygen generators for tumor-favoring theranostics. Biomaterials. 2020 Feb;230:119635.