分子靶向治疗由于其在选择性抑制癌细胞、最小化副作用和优于常规化疗药物的抗癌效果等方面的优势而吸引了广泛的关注。到目前为止,许多分子靶向抗癌药物,包括表皮生长因子受体抑制剂、生长因子抑制剂、酪氨酸激酶抑制剂、以及单克隆抗体等,已经被开发并获得FDA批准,其主要作用机制是直接参与癌细胞增殖、细胞分裂、细胞周期调控等分子的药理作用。此外,近年来,人们对诱导肿瘤相关蛋白降解的药物产生了极大的研究兴趣(如PROTACs和分子胶水等),这些药物为精准治疗癌症开辟了新的途径。尽管有上述令人兴奋的进展,目前可用的分子靶向抗癌药物的作用机制很少涉及诱导肿瘤相关蛋白聚集。然而,最近的研究报道,对于大量的癌症相关蛋白,特别是受体(如DR5,CD20等),其聚集体是驱动细胞信号传导和将激活信息转移到细胞应答的关键。这意味着能够诱导癌症相关蛋白人工聚集的分子靶向抗癌药物具有很大的价值和前景。
另一方面,在分子靶向抗癌药物和肿瘤免疫冷热特性之间建立起桥梁的研究相当有限。具有较高的肿瘤浸润淋巴细胞的热肿瘤微环境对大多数免疫治疗获得高抗肿瘤反应起着至关重要的作用。例如,阻断免疫检查点抑制剂(PD-1/PD-L1、CTLA-4)的免疫治疗在癌症治疗中具有划时代意义。这种免疫治疗方法对热肿瘤有很好的治疗效果,但对免疫细胞浸润较少的冷肿瘤的应答率较低。因此,能将冷肿瘤微环境转化为热肿瘤微环境的药物是迫切需要的。
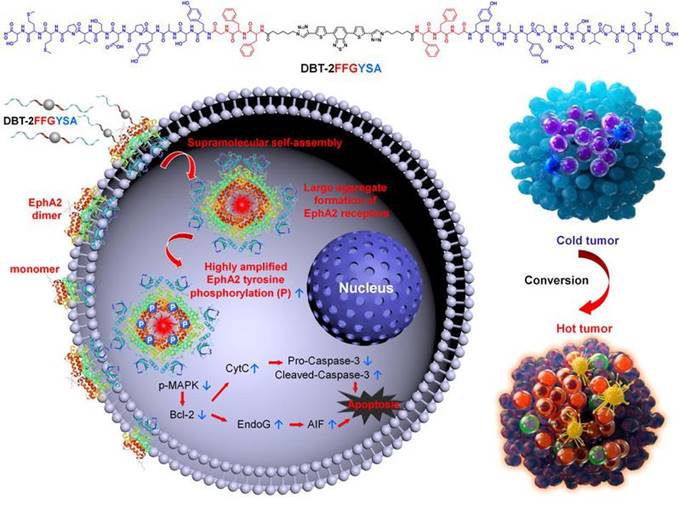
基于此,南开大学丁丹教授课题组发展了一种新型高效的基于超分子自组装多肽的分子靶向抗癌分子。该分子(命名为DBT-2FFGYSA)包含环境敏感荧光分子DBT,靶向肿瘤过表达EphA2蛋白受体的多肽序列以及促进组装的序列FFG。DBT-2FFGYSA在水溶液中不发光,一旦与EphA2蛋白发生特异性结合,其荧光能够选择性大幅开启,使EphA2受体可视化。另一方面,DBT的“两只手臂”以及整个分子的组装性能能够诱导大量的EphA2受体聚集。蛋白的聚集增强了蛋白-蛋白间的相互作用,促进了EphA2受体间的交叉磷酸化,并开启了下游的凋亡和自噬通路(基因组学与western blot实验证明),从而有效地抑制了肿瘤细胞的增殖。更重要的是,DBT-2FFGYSA诱导EphA2蛋白过表达癌细胞死亡的方式为免疫原性死亡,并且招募了大量的肿瘤浸润T细胞(CD4+ T细胞,激活的CD8+ T细胞,TNF-α+ CD8+, 和IFN-γ+ CD8+ T细胞增多),从而使冷肿瘤转变为热肿瘤。这项研究提供了一类没有已知抗癌药物参与但能够使免疫冷肿瘤变热的新型分子靶向试剂。
相关文献:
Li J#, Fang Y#, Zhang Y, Wang H, Yang Z, Ding D*. Supramolecular Self-Assembly-Facilitated Aggregation of Tumor-Specific Transmembrane Receptors for Signaling Activation and Converting Immunologically Cold to Hot Tumor, Advanced Materials, 2021; 33: 2008518.